जीवित कोशिकाओं के गतिशील वातावरण में प्रोटीन लगातार खींचे, धकेले और मोड़े जाते हैं। यह यांत्रिक तनाव कोशिकाओं के भीतर होने वाली आवश्यक प्रक्रियाओं — जैसे परिवहन, अपघटन और साइटोस्केलेटल पुनर्निर्माण — के दौरान उत्पन्न होता है। ऐसे तनाव प्रोटीन की संरचना (folding) और उनके कार्य को गहराई से प्रभावित करते हैं। अब तक वैज्ञानिकों का ध्यान मुख्यतः उन विशेष प्रोटीनों पर केंद्रित रहा है जिन्हें कैनोनिकल चैपरोन्स कहा जाता है और जो प्रोटीन को सही ढंग से फोल्ड करने में मदद करते हैं। लेकिन हाल के शोध ने यह प्रश्न उठाया कि क्या उनके सहायक सहकारक (cofactors) भी प्रत्यक्ष रूप से प्रोटीन को यांत्रिक तनाव से बचाने में सक्षम हो सकते हैं।
इसी दिशा में कोलकाता स्थित एस. एन. बोस नेशनल सेंटर फॉर बेसिक साइंसेज (SNBNCBS) के शोधकर्ताओं ने एक महत्वपूर्ण खोज की है। डॉ. शुभाशीष हलदर के नेतृत्व में किए गए इस अध्ययन ने यह स्पष्ट किया है कि p47 नामक प्रोटीन, जिसे अब तक केवल एक सहायक कारक माना जाता था, वास्तव में प्रोटीन को यांत्रिक तनाव से बचाने में स्वतंत्र रूप से सक्षम है। यह अध्ययन बायोकैमिस्ट्री (Biochemistry) पत्रिका में प्रकाशित हुआ है और रासायनिक अनुसंधान सोसाइटी ऑफ इंडिया (CRSI) की 25वीं वर्षगांठ विशेषांक का हिस्सा है।
p47 : सहायक से नायक तक
आम तौर पर p47 को p97 नामक प्रोटीन मशीन का सहायक माना जाता था। p97 कोशिकाओं में प्रोटीन के परिवहन और अपघटन की प्रक्रिया में एक केंद्रीय भूमिका निभाता है। वहीं, p47 को केवल प्रोटीन यातायात, अपघटन और झिल्ली संलयन (membrane fusion) जैसे कार्यों तक सीमित समझा जाता था।
लेकिन शोधकर्ताओं ने सिंगल-मॉलिक्यूल मैग्नेटिक ट्वीज़र्स तकनीक का उपयोग करके एक नई सच्चाई उजागर की। इस तकनीक के जरिए उन्होंने व्यक्तिगत प्रोटीन अणुओं पर नियंत्रित यांत्रिक बल डाले और उन परिस्थितियों की नकल की जिनका सामना प्रोटीन कोशिकाओं में सामान्य रूप से करते हैं।
यांत्रिक चैपरोन के रूप में p47
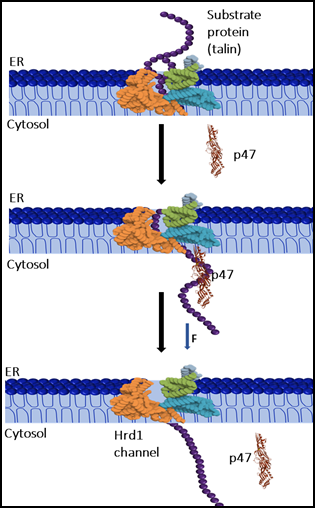
अध्ययन में पाया गया कि p47 केवल p97 का सहायक नहीं है, बल्कि यह सीधे खिंचे हुए प्रोटीन से जुड़कर उन्हें फिर से फोल्ड होने में मदद करता है। यह क्षमता यांत्रिक चैपरोन (mechanical chaperone) जैसी है। दूसरे शब्दों में, p47 प्रोटीन को निरंतर खिंचाव के दौरान भी स्थिर बनाए रखने और उनकी संरचना बहाल करने में सक्षम है। यह गुण अब तक केवल कैनोनिकल चैपरोन्स में देखा गया था, लेकिन p47 में इस प्रकार की गतिविधि पहले कभी दर्ज नहीं की गई थी।
डॉ. हलदर की टीम ने यह भी स्पष्ट किया कि p47 एंडोप्लाज्मिक रेटिकुलम (ER) से साइटोप्लाज्म तक प्रोटीन को खींचने की प्रक्रिया में भाग लेता है। इसकी चैपरोन जैसी विशेषताएँ इस यांत्रिक प्रक्रिया को अधिक प्रभावी बनाती हैं और पॉलीपेप्टाइड्स को छिद्र (pore) के माध्यम से स्थानांतरित करने में मदद करती हैं।
चिकित्सा उपचार में संभावनाएँ
इस खोज का महत्व केवल कोशिका जीवविज्ञान तक सीमित नहीं है। p47 जैसे सहकारक प्रोटीन को लक्षित करना उन बीमारियों के लिए एक नई उपचारात्मक दिशा हो सकती है जिनमें यांत्रिक तनाव के कारण प्रोटीन की स्थिरता प्रभावित होती है। इसमें हृदय की मांसपेशियों से जुड़ी बीमारियाँ (heart muscle diseases) और लैमिनोपैथी (laminopathies) जैसी आनुवंशिक विकार शामिल हैं।
यह अध्ययन यह भी संकेत देता है कि सहायक प्रोटीन, जिन्हें अब तक केवल “पृष्ठभूमि का सहायक” समझा जाता था, वास्तव में कोशिका की यांत्रिक व्यवस्था और प्रोटीन गुणवत्ता नियंत्रण में एक स्वतंत्र और निर्णायक भूमिका निभा सकते हैं।





